Égression et protéines phosphatases chez P. falciparum
Chef de groupe : Dr. Mauld Lamarque
L'EGRESS ET LA PHOSPHATASE PP1 DU PARASITE CHEZ PLASMODIUM FALCIPARUM
Projet sur l'évacuation et la phosphatase PP1 du parasite
La prolifération asexuée du parasite du paludisme Plasmodium falciparum dans les globules rouges (GR) suit un programme de développement qui alterne la réplication intra-érythrocytaire dans une vacuole parasitophore (PV) et la dissémination dans de nouvelles cellules hôtes. La sortie des érythrocytes est stimulée en temps opportun par une voie dépendante du GMPc et du calcium qui active respectivement la protéine kinase PfPKGdépendante du GMPc et la kinase PfCDPK5dépendante du calcium. Cela déclenche à son tour l'exocytose d'organites sécrétoires, à savoir les exonèmes et les micronèmes, permettant la libération d'effecteurs clés nécessaires à la rupture de la membrane PV environnante et de la membrane de l'hôte. Avant l'activation de la PfPKG, des modifications morphologiques précoces de la PV ont été décrites, notamment la poration et le gonflement de la PV, également connus sous le nom d'étape "d'arrondissement", mais les effecteurs moléculaires impliqués sont encore inconnus.
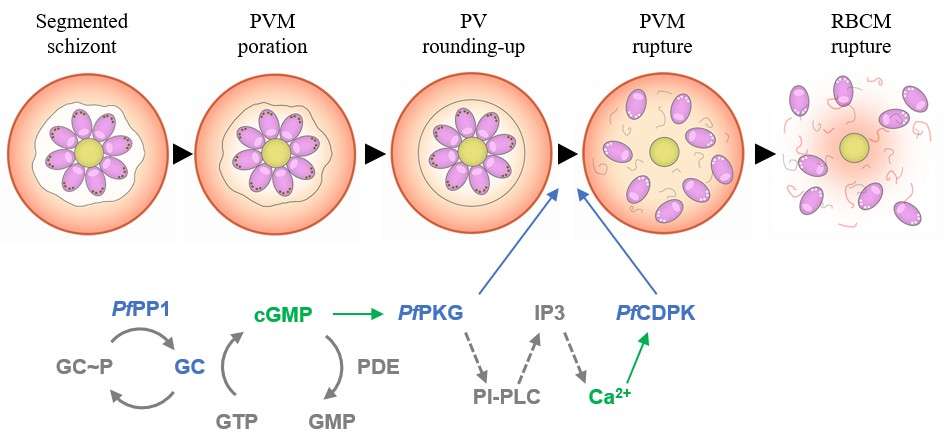
Le schéma de sortie du parasite chez P. falciparum . La sortie des mérozoïtes du globule rouge (GR) de l'hôte nécessite que le parasite franchisse successivement les membranes environnantes : la membrane de la vacuole parasitophore (PVM) et la membrane du GR (GR). Après la fin de la schizogonie (étape 1), deux modifications morphologiques de la PV ont lieu, à savoir la poration de la PVM et l'arrondissement de la PV (étape 2). Ensuite, une augmentation de la concentration de GMPc, probablement régulée par la phosphatase parasitaire PP1, active son effecteur en aval, la kinase parasitaire PKG qui, à son tour, conduit à une augmentation de la concentration de calcium intracellulaire activant la kinase CDPK5 (étape 3). Ces kinases sont nécessaires pour déclencher l'exocytose d'organites parasitaires spécifiques, à savoir les exonèmes et les micronèmes, libérant ainsi des effecteurs clés de la sortie. PP1, PKG et CDPK5 sont nécessaires à la rupture du PVM (étape 3). Enfin, il a été observé qu'un seul pore est formé et stabilisé dans la GRM et que l'enroulement et la déformation de cette membrane permettent la libération et la dispersion efficaces des mérozoïtes dans le milieu extracellulaire (étapes 4 et 5). Outre la formation du pore, la déstabilisation du cytosquelette des GR par les protéines du parasite est également nécessaire. Source : Collins et al. 2013, Brochet et al. 2014, Yeoh et al. 2007, Dvorin et al. 2010, Garg et al. 2013, Absalon et al. 2018, Abkarian et al. 2011, Das et al. 2015, Thomas et al. 2018, Hale et al. 2017, Glushakiva et al. 2018, Paul et al. 2020.
Nous avons identifié la protéine phosphatase PP1 (PfPP1) comme un régulateur principal de la voie de signalisation d'évacuation6. Une lignée de mutants conditionnels DiCre pour PfPP1(PfPP1-iKO) ne parvient pas à rompre la membrane PV (PVM) en raison d'une incapacité à sécréter des exonèmes et des micronèmes. Une analyse phosphoprotéomique du mutant PfPP1a révélé une phosphorégulation de la guanylate cyclase (GC), l'enzyme responsable de la synthèse du GMPc, plaçant ainsi PfPP1en amont de la PfPKGbien caractérisée dans la cascade de signalisation de l'érosion.
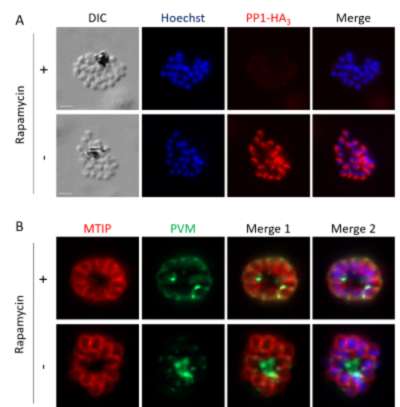
Figure : PP1 est nécessaire à la rupture du PVM au moment de l'égression.
(A) IFA montrant la déplétion de la protéine PP1-HA3 lors du traitement à la rapamycine dans la lignée inductible PP1 knock-out (PP1-iKO), basée sur l'excision conditionnelle du gène pp1 par une recombinase Cre dimérisable. (B) IFA montrant que chez les parasites témoins (- rapamycine), la rupture de la PVM a lieu comme le montre la détection de verticilles membranaires, contrairement aux parasites dépourvus de PP1 (+ rapamycine) qui restent enfermés à l'intérieur de la PVM.
Comme le mécanisme des premières étapes de l'égression est mal compris, notre projet vise à utiliser PP1 pour élargir nos connaissances sur la voie d'égression et pour explorer sa contribution dans la biologie des stades sexuels de Plasmodium, en particulier lors de l'égression des gamétocytes. Pour cela, nous combinerons des technologies de pointe en parasitologie cellulaire et moléculaire afin de définir précisément l'étape d'égression contrôlée par PP1, d'évaluer la contribution de PP1 dans le développement des stades sexuels, d'identifier les cibles de la phosphatase spécifiques de l'égression et de déterminer dans quelle mesure ces cibles représentent de nouveaux effecteurs moléculaires de la voie de signalisation de l'égression. La meilleure compréhension des fonctions de PP1 dans la biologie du Plasmodium et dans l'évacuation peut ouvrir la voie à de futures stratégies d'intervention.