Projets de recherche - Équipe 6
GROUPE 1 : ACTIVATION DES CELLULES IMMUNITAIRES
Chef de groupe : Dr. Mai NGUYEN CHI
L'immunité innée est en première ligne pour contrecarrer l'invasion des micro-organismes. Le poisson zèbre s'est avéré particulièrement adapté à l'étude de la réponse immunitaire aux infections et aux blessures. Grâce à l'adaptabilité génétique et à la transparence de ses larves et de ses embryons, il offre une occasion exceptionnelle de déchiffrer la dynamique de l'activation des cellules immunitaires dans les tissus infectés et endommagés.
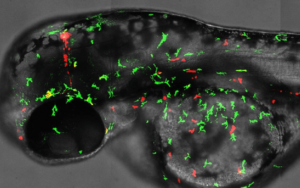
Notre groupe utilise les larves de poisson zèbre pour comprendre comment les phagocytes se différencient et combattent les microbes.
GROUPE 2 : SIGNAUX DE DANGER ET INFLAMMATION CHRONIQUE
Chef de groupe : Dr. Laure YATIME
L'inflammation est un processus naturel généré par notre système immunitaire en réponse à une agression externe ou interne. Un organisme sain est généralement capable de l'atténuer et de rétablir l'homéostasie lorsque la menace est éliminée. À l'inverse, une inflammation incontrôlée peut être délétère pour l'organisme et causer de graves dommages, pouvant entraîner des maladies ou exacerber une pathologie sous-jacente si l'inflammation devient chronique.
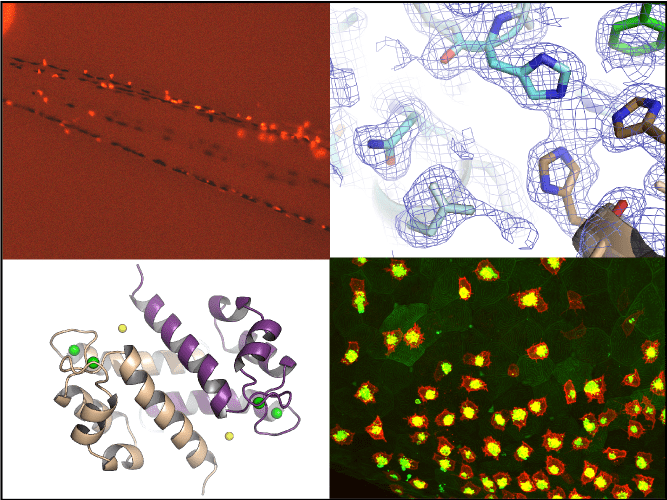
Nous nous intéressons aux acteurs moléculaires du système immunitaire inné dont l'activation excessive par des signaux de danger pathogènes ou endogènes provoque une inflammation chronique liée à des pathologies humaines telles que les maladies hémolytiques, les maladies inflammatoires de l'intestin ou les cancers. Nos travaux actuels visent à comprendre comment la reconnaissance de ces signaux de danger par des récepteurs immunitaires spécifiques génère une réponse pro-inflammatoire favorisant la progression de ces pathologies. Pour ce faire, nous utilisons une approche multidisciplinaire combinant la biochimie, la biologie cellulaire, la biologie structurale et la modélisation in vivo chez le poisson zèbre.
GROUPE 3 : DÉFENSES ANTIBACTÉRIENNES ET INFLAMMATION AU COURS DE LA MUCOVISCIDOSE
Chef de groupe : Dr. Audrey BERNUT
La mucoviscidose est l'une des maladies génétiques mortelles les plus fréquentes au monde. Chez les patients atteints de mucoviscidose, les mutations du gène cftr déclenchent l'accumulation d'un mucus épais dans les voies respiratoires. Cela favorise une colonisation récurrente par différentes bactéries pathogènes ainsi qu'une réponse immunitaire exagérée qui, ensemble, conspirent pour provoquer des lésions pulmonaires mortelles. En outre, les mutations de la CFTR peuvent avoir un impact sur les réponses immunitaires des patients, rendant ces réponses plus nocives pour l'hôte et moins efficaces dans la lutte contre les bactéries pathogènes. Cependant, les mécanismes par lesquels la CFTR agit sur ces processus sont mal compris.
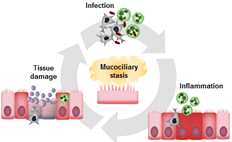
Afin d'améliorer notre compréhension de cette réponse immunitaire altérée dans la mucoviscidose, nous avons développé une approche basée sur l'utilisation de modèles de poissons zèbres déficients en CFTR. Grâce à sa transparence, la larve de poisson zèbre est un système in vivo inégalé pour visualiser et étudier les effets directs d'un CFTR dysfonctionnel sur les réponses anti-infectieuses et inflammatoires à l'échelle cellulaire et nous permet d'examiner certains aspects de la pathologie pulmonaire associée à la maladie.
Grâce à l'utilisation de larves de poisson zèbre, nos travaux visent à :
1. évaluer comment CFTR régule les réponses immunitaires innées et comment son déséquilibre peut favoriser l'infection et l'inflammation dans la FK,
2. identifier des composés thérapeutiques susceptibles de restaurer l'équilibre immunitaire et le contrôle de l'infection.
GROUPE 4 : MÉCANISMES DE SURVIE BACTÉRIENNE INTRAMACROPHAGE ET STRATÉGIES ANTI-VIRULENCE
Chef de groupe : Dr. Anne BLANC-POTARD
Notre objectif est de mieux comprendre la phase intramacrophagique rencontrée par la bactérie extracellulaire pathogène Pseudomonas aeruginosa, en particulier dans le contexte de la mucoviscidose (CF). Nous avons identifié différents facteurs bactériens impliqués dans cette étape, qui constituent des cibles thérapeutiques pour de nouvelles molécules anti-infectieuses.
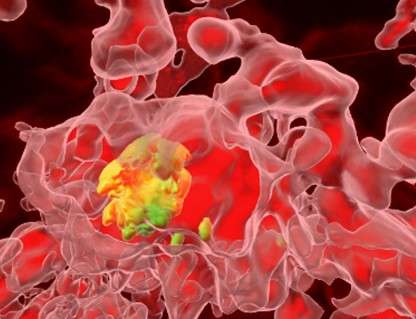
Nous développons le modèle de l'embryon de poisson zèbre pour définir l'implication de cette phase intramacrophagique dans l'établissement et la persistance de l'infection, dans un contexte normal ou de FK. Nous utilisons également ce modèle vertébré pour tester de nouvelles stratégies visant à limiter l'infection par P. aeruginosa.
GROUPE 5 : COMMUNICATION CELLULAIRE DANS LA NICHE HÉMATOPOÏÉTIQUE
Chef de groupe : Dr. Etienne LELIEVRE
Après leur émergence de l'endothélium hémogène de l'aorte, les cellules souches hématopoïétiques (CSH) rejoignent et ensemencent un organe hématopoïétique transitoire, le tissu hématopoïétique caudal (CHT). Le TCH est un plexus vasculaire complexe composé de cellules endothéliales, de cellules stromales et de prolongements neuronaux qui permet l'expansion et la différenciation des CSH pour donner naissance à des progéniteurs ainsi qu'à des cellules hématopoïétiques matures.
Le repérage des CSH dans le CHT implique des interactions physiques avec les cellules endothéliales et stromales qui déclenchent le réarrangement des cellules endothéliales pour former des "poches de cellules souches" qui fournissent l'environnement adéquat pour la prolifération des CSH et un bon équilibre entre le maintien du caractère souche et la différenciation.
Nos travaux se concentrent actuellement sur la caractérisation des mécanismes à l'œuvre chez les poissons déficients en composants de la superfamille TGF-beta/BMP qui présentent une greffe de CSH compromise dans le CHT. Nos résultats actuels serviront de base à un projet plus large visant à comprendre, aux niveaux cellulaire et moléculaire, comment les CSH, les cellules endothéliales, les cellules stromales et les nerfs dialoguent pour établir une niche hématopoïétique pleinement opérationnelle.