Projets de recherche - Groupe L. Yatime
La détection des motifs moléculaires associés aux pathogènes et aux dommages (PAMPs et DAMPs) par les acteurs conventionnels du système inné (système du complément ou récepteurs de type Toll, par exemple) a fait l'objet d'études approfondies. D'autre part, les vertébrés possèdent de nombreux autres capteurs de ce type qui doivent encore être caractérisés. Nos recherches actuelles se concentrent sur plusieurs récepteurs scavenger de la superfamille des immunoglobulines impliqués dans la reconnaissance d'alarmines endogènes ou de facteurs de virulence pathogènes, tous liés à des conditions inflammatoires chez l'homme.
Les récepteurs de la superfamille des immunoglobulines (IgSF) sont des récepteurs membranaires qui contiennent uniquement des domaines d'immunoglobulines (Ig) dans leur région extracellulaire. Comme les domaines Ig ont tendance à s'homodimériser en cis ou en trans, de nombreux récepteurs de la superfamille des immunoglobulines sont sujets à des interactions homophiles et/ou hétérophiles. Par conséquent, ils sont souvent impliqués dans les processus d'adhésion cellulaire et contribuent à de nombreuses fonctions cellulaires vitales, notamment la motilité, la prolifération et la différenciation des cellules, la réorganisation du cytosquelette, la croissance neuronale ou la réponse immunitaire. En raison de leurs propriétés adhésives, ces récepteurs jouent également un rôle central dans de nombreuses pathologies humaines, notamment le cancer et les infections, et sont des vecteurs très robustes de l'inflammation.
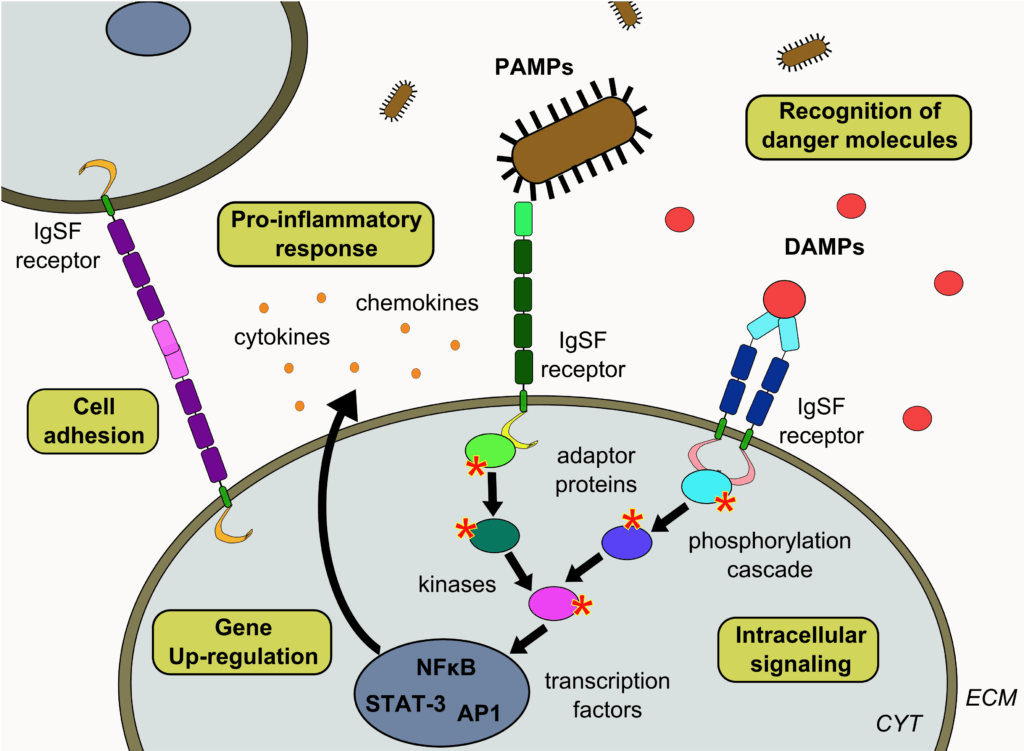
Figure 1 : Les récepteurs des IgSF et leur rôle dans les processus d'adhésion cellulaire et dans la reconnaissance des molécules de danger (DAMPs et PAMPs).
Parmi cette grande famille de récepteurs, nous nous intéressons à deux sous-classes impliquées dans la reconnaissance de signaux de stress dangereux qui sont soit endogènes (DAMPs), soit associés à des pathogènes (PAMPs) :
- le récepteur multiligand RAGE, qui détecte une large gamme d'alarmines endogènes impliquées dans le cancer, le diabète ou les troubles neurodégénératifs
- les récepteurs CEACAM responsables de la reconnaissance de divers pathogènes intestinaux dans le contexte des maladies inflammatoires de l'intestin (MICI)
AXE 1 : DÉTECTION DES ALARMINES S100 PAR LE RÉCEPTEUR RAGE AU COURS DU CANCER
Les protéines S100, spécifiques aux vertébrés, se trouvent normalement à l'intérieur des cellules. En se liant au calcium, elles régulent les processus intracellulaires dépendants du calcium, notamment la transcription, la dynamique du cytosquelette, la croissance et la différenciation cellulaires, ainsi que l'homéostasie du calcium. Dans un contexte de stress cellulaire et d'inflammation lié au développement du cancer, les protéines S100 sont surexprimées et peuvent être libérées dans l'environnement extracellulaire où elles deviennent des molécules de danger reconnues par le récepteur RAGE. Cette détection induit une réponse pro-inflammatoire qui favorise la progression de la tumeur. Par conséquent, les interactions RAGE-S100 sont considérées comme de nouvelles cibles prometteuses pour le développement de nouvelles thérapies anticancéreuses.
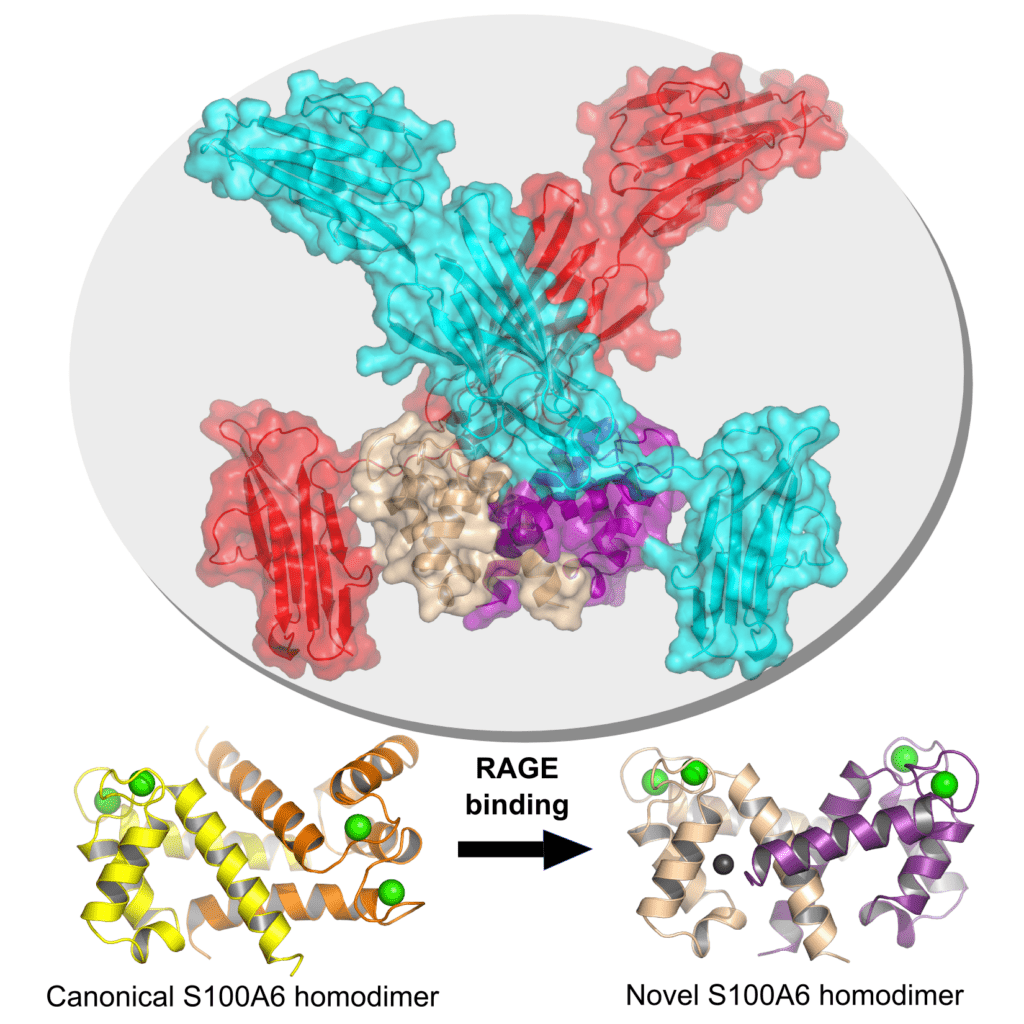
Figure 2 : Structure cristalline du complexe RAGE-S100A6 à une résolution de 2,3 Å (en haut). Forme apo canonique (en bas, à gauche) et nouvelle forme observée lors de la liaison avec RAGE (en bas, à droite) pour l'homodimère S100A6.
Nos travaux, basés sur des approches biochimiques et structurales, ainsi que sur la modélisation in vivo chez le poisson zèbre, visent à élucider les mécanismes de reconnaissance de ces protéines S100 par le récepteur RAGE, afin de concevoir des inhibiteurs thérapeutiques ciblant ces interactions. Nous avons récemment réussi à déterminer la première structure cristallographique d'un complexe complet entre RAGE et la protéine S100A6. Cette structure a révélé une nouvelle forme homodimérique de S100A6, potentiellement responsable de l'activité pro-inflammatoire de la protéine. Nos efforts actuels se concentrent sur l'analyse d'autres complexes RAGE-S100, afin de déterminer si cette nouvelle forme est observée pour d'autres protéines S100. Nous étudions également comment les ions divalents et les propriétés oxydatives rencontrés dans la matrice extracellulaire affectent l'architecture 3D de ces protéines et quel est l'impact associé sur leurs propriétés inflammatoires.
AXE 2 : RECONNAISSANCE DES PATHOGÈNES INTESTINAUX PAR LES RÉCEPTEURS CEACAM AU COURS DE L'IBD
Les maladies inflammatoires de l'intestin constituent un véritable problème de santé publique en raison de leur incidence croissante, notamment dans les pays développés où l'alimentation (graisses et sucres), le mode de vie (stress, alcool, tabagisme) et les conditions environnementales (pollution, faible ensoleillement) favorisent leur développement. Le microbiote intestinal joue un rôle essentiel dans la pathogenèse de ces maladies par des interactions délétères répétées avec les cellules hôtes de l'épithélium intestinal, chez des individus fragilisés par des déficiences génétiques. Ceci contribue au maintien d'un état inflammatoire élevé qui représente la principale manifestation pathologique des MICI telles que la maladie de Crohn ou la colite ulcéreuse.
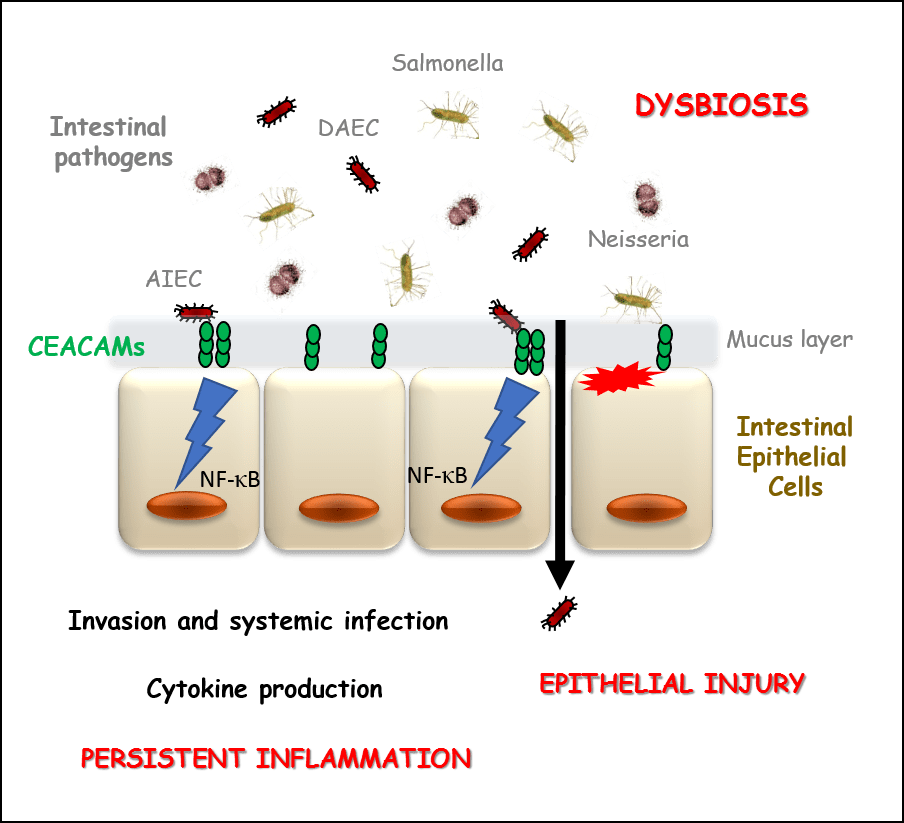
Figure 3 : Les interactions CEACAM-pathogènes favorisent la persistance d'un état inflammatoire élevé au cours des MICI.
Les récepteurs CEACAMs, présents sur l'épithélium intestinal, sont utilisés comme points d'ancrage par des pathogènes intestinaux tels que les Escherichia coli adhésifs invasifs (AIEC), les Escherichia coli à adhérence diffuse (DAEC), les souches neisseuses ou les salmonelles. Ces interactions hôte-pathogène génèrent une réponse inflammatoire exacerbée, par la production de cytokines pro-inflammatoires (TNF-alpha, interleukines), qui ne peuvent plus être contrôlées par notre organisme. Ce processus permet l'internalisation des pathogènes et leur échappement immunitaire, ce qui perpétue l'état inflammatoire élevé. Nous cherchons à caractériser le mode précis de reconnaissance de ces pathogènes intestinaux par les différents membres de la famille CEACAM, afin de concevoir des inhibiteurs spécifiques de ces interactions pour une application dans le traitement des MICI.