Projets de recherche - Groupe S. Besteiro
Projet de recherche n° 1. L'apicoplaste comme cible médicamenteuse dans le contexte de la toxoplasmose aiguë
Comme plusieurs autres parasites médicalement importants du phylum Apicomplexa (c'est-à-dire les parasites responsables du paludisme, le Plasmodium), T. gondii contient un organite inhabituel appelé apicoplaste. Cet organite est une particularité étonnante qui non seulement met en évidence la diversité de la biologie cellulaire eucaryote, mais qui peut également être exploitée pour le développement thérapeutique. Ce plastide à quatre membranes a été acquis par une endosymbiose secondaire inhabituelle, au cours de laquelle une algue a été engloutie par un autre eucaryote, formant un nouveau plastide secondaire dans l'hôte. Bien que l'apicoplaste ait perdu sa fonction photosynthétique, il abrite plusieurs voies métaboliques importantes pour la production : cluster fer/soufre, hème, acides gras (FASII), isoprénoïdes(Fig. 2).
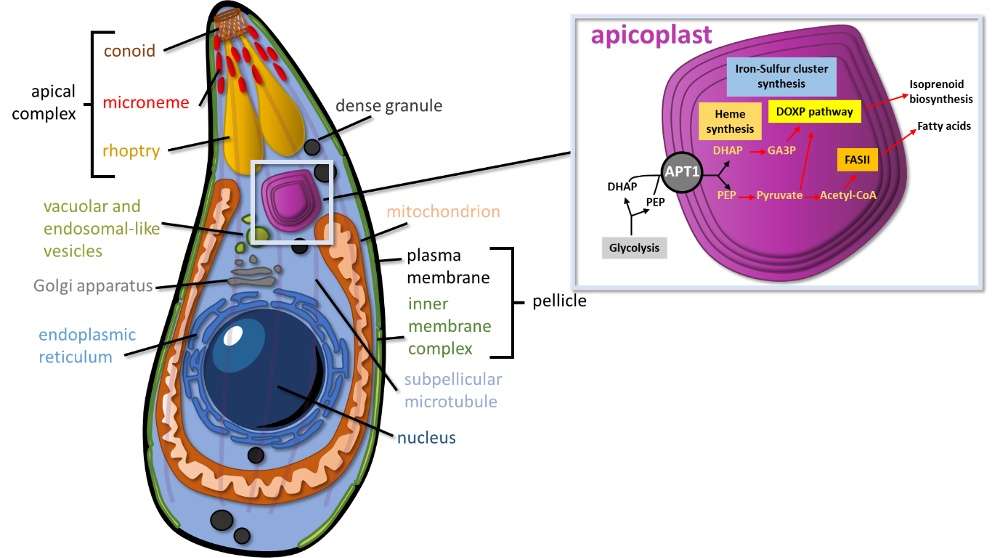
Figure 2. Représentation schématique d'un tachyzoïte de Toxoplasma, avec un apicoplaste à quatre membranes et les principales voies biochimiques qu'il héberge.
Bien que l'apicoplaste soit connu comme un centre métabolique important pour de nombreuses espèces de parasites apicomplexes, les voies métaboliques qui sont absolument essentielles à la viabilité du parasite peuvent varier en fonction du parasite ou du stade de développement. Par exemple, T. gondii a un cycle de vie complexe impliquant plusieurs stades de développement qui se développent chez les félidés (les hôtes définitifs, où la reproduction sexuelle a lieu), mais qui se divisent également de manière asexuée dans les nombreuses espèces d'animaux à sang chaud qui peuvent agir en tant qu'hôtes intermédiaires. Les deux formes de développement que l'on trouve dans les hôtes intermédiaires sont le tachyzoïte et le bradyzoïte. Les tachyzoïtes sont des formes à division rapide associées à la phase aiguë de la toxoplasmose. Sous le contrôle d'un système immunitaire compétent, les parasites peuvent toutefois se différencier en bradyzoïtes à croissance lente, qui s'établissent dans des kystes tissulaires et sont responsables de la phase chronique de la toxoplasmose.
L'apicoplaste est déjà ciblé par des médicaments antiparasitaires (par exemple par le biais de plusieurs inhibiteurs de traduction procaryotes) et il a été démontré que les voies de synthèse de l'hème, des acides gras et des isoprénoïdes hébergées par l'apicoplaste contribuent toutes à la bonne santé du stade tachyzoïte. Cependant, plusieurs voies métaboliques restent inexplorées et inexploitées en tant que cibles médicamenteuses potentielles.
Ce projet de recherche vise à :
► identification de nouvelles fonctions spécifiques aux parasites hébergés par l'apicoplaste
► évaluer s'ils peuvent être exploités pour cibler le stade tachyzoïte
Ces dernières années, nous nous sommes concentrés sur les voies de synthèse des clusters fer-soufre, dont l'une est hébergée par l'apicoplaste et est essentielle à la viabilité du tachyzoïte, alors qu'elle est absente des hôtes mammifères du parasite.
Dernières publications liées à ce projet :
Renaud EA, Pamukcu S, Cerutti A, Berry L, Lemaire-Vieille C, Yamaryo-Botté Y, Botté CY, Besteiro S. (2022) Disrupting the plastidic iron-sulfur cluster biogenesis pathway in Toxoplasma gondii has pleiotropic effects irreversibly impacting parasite viability . J Biol Chem. Aug;298(8):102243. doi : 10.1016/j.jbc.2022.102243.
Pamukcu S, Cerutti A, Bordat Y, Hem S, Rofidal V, Besteiro S. (2021) Differential contribution of two organelles of endosymbiotic origin to iron-sulfur cluster synthesis and overall fitness in Toxoplasma . PLoS Pathog. 17(11):e1010096. doi : 10.1371/journal.ppat.1010096.
Projet de recherche n°2. Contribution de l'apicoplaste à la persistance de Toxoplasma
Comme mentionné ci-dessus, l'infection aiguë des hôtes intermédiaires par T. gondii est associée à la réplication et à la propagation rapides des formes de tachyzoïtes dans l'organisme. Cette phase d'infection est souvent facilement contenue par le système immunitaire. Cependant, les parasites peuvent se différencier en bradyzoïtes à croissance lente, s'établissant dans des kystes tissulaires, principalement dans le système nerveux central et les muscles. Bien qu'il existe des médicaments efficaces contre les tachyzoïtes, la forme chronique persistante de l'agent pathogène reste dans l'hôte tout au long de sa vie et peut se reconvertir à plusieurs reprises en tachyzoïtes, ce qui peut entraîner une pathologie grave (encéphalite ou rétinite) en cas d'affaiblissement du système immunitaire. Ces formes bradyzoïtes sont donc au cœur de la pathologie, mais il n'existe à ce jour aucun médicament efficace contre elles.
Chez les bradyzoïtes, où la fonction de l'apicoplaste a été largement négligée, nous avons cherché à déterminer l'importance de l'organite pour la survie et la persistance de ce stade parasitaire. Nous avons utilisé des approches conditionnelles knock-down ou knock-out spécifiques au stade pour épuiser les protéines de l'apicoplaste chez les bradyzoïtes(Fig. 3).
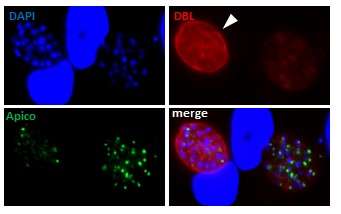
Figure 3. Appauvrissement d'un marqueur d'apicoplaste (vert) en fonction du stade dans des bradyzoïtes différenciés in vitro (pointe de flèche, kyste marqué par la lectine Dolichos biflorus -DBL, rouge-).
Grâce à ce projet de recherche, nous avons
► création d'outils génétiques pour étudier la fonction de gènes essentiels dans les bradyzoïtes
► montré l'importance de l'apicoplaste dans la persistance et la réactivation des bradyzoïtes in vitro et in vivo (collaboration avec le laboratoire de Nicolas Blanchard, Université de Toulouse, France)(
Dernières publications liées à ce projet :
Sanchez SG, Bassot E, Cerutti A, Mai Nguyen H, Aïda A, Blanchard N, Besteiro S. (2023) The apicoplast is important for the viability and persistence of Toxoplasma gondii bradyzoites. Proc Natl Acad Sci U S A. Aug 22;120(34):e2309043120. doi : 10.1073/pnas.2309043120.
Cerutti A, Blanchard N, Besteiro S. (2020) The Bradyzoite : A Key Developmental Stage for the Persistence and Pathogenesis of Toxoplasmosis. Pathogens. Mar 21;9(3):234. doi : 10.3390/pathogens9030234.
Autres projets de recherche
Nous nous intéressons également à d'autres aspects de la biologie cellulaire de Toxoplasma, notamment des aspects spécifiques du processus de division cellulaire, le cytosquelette, ainsi que les fonctions canoniques et non canoniques de la machinerie d'autophagie.
Il s'agit notamment de
► élucider les rôles physiologiques de l'autophagie parasitaire dans le contexte de la toxoplasmose aiguë et chronique (collaboration avec les laboratoires d'Ellen Yeh, Stanford Uni., USA et de Vern Carruthers, Univ. Michigan, USA)
► identification de nouvelles fonctions spécifiques au parasite pour la machinerie liée à l'autophagie dans l'apicoplaste
Dernières publications liées à ce projet :
Walczak M, Meister TR, Nguyen HM, Zhu Y, Besteiro S, Yeh E. (2023) Structure-Function Relationship for a Divergent Atg8 Protein Required for a Nonautophagic Function in Apicomplexan Parasites. mBio. Feb 28;14(1):e0364221. doi : 10.1128/mbio.03642-21.
Smith D, Kannan G, Coppens I, Wang F, Nguyen HM, Cerutti A, Olafsson EB, Rimple PA, Schultz TL, Mercado Soto NM, Di Cristina M, Besteiro S, Carruthers VB. (2021) Toxoplasma TgATG9 est essentiel pour l'autophagie et la persistance à long terme dans les kystes tissulaires . Elife. Apr 27;10:e59384. doi : 10.7554/eLife.59384.