Projets de recherche - Équipe A. Claessens
INTRODUCTION :
Données de base sur le paludisme :
- Causée par les parasites Plasmodium (eucaryote unicellulaire)
- Transmis par les moustiques anophèles
- Les parasites Plasmodium passent la majeure partie de leur vie asexuée à l'intérieur des globules rouges, avec un cycle de réinvasion toutes les 48 heures.
- Plus d'un demi-million de décès par an, principalement des enfants d'Afrique subsaharienne infectés par Plasmodium falciparum.
Paludisme en Gambie, Afrique de l'Ouest
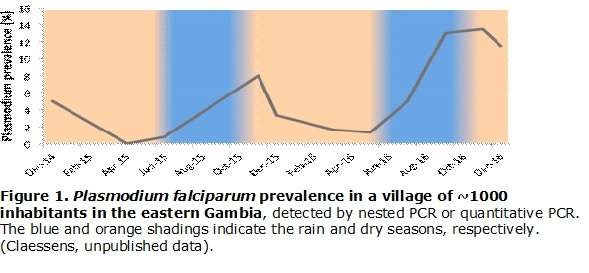
Lorsque la transmission du paludisme est saisonnière, comme en Gambie (Afrique de l'Ouest), elle se produit pendant et immédiatement après les pluies (juin-décembre). Pendant la saison sèche (janvier-mai), il n'y a pas de transmission, pratiquement aucun cas clinique n'est diagnostiqué pendant ces mois secs et il y a moins de moustiques[1,2]. La plupart de ces infections disparaîtront naturellement, provoquant un goulot d'étranglement de la population parasitaire (Fig. 1). Cependant, certains parasites P. falciparum survivent en établissant des infections chroniques et asymptomatiques pendant toute la saison sèche. Ces infections constituent le réservoir à partir duquel le pic saisonnier redémarrera lors de la prochaine saison de transmission.
Nos recherches actuelles se concentrent sur les infections asymptomatiques à P. falciparum pour trois raisons principales :
- Infections asymptomatiques : loin des yeux, loin du cœur
- Chaque jour, la grande majorité des infections à P. falciparum sont asymptomatiques, mais elles ont été peu étudiées (Fig. 2). Actuellement, notre connaissance de la biologie du parasite est basée sur des isolats dérivés de cas cliniques, et généralement de parasites clonaux adaptés à la culture. La différence entre les infections asymptomatiques et les cas cliniques n'a pratiquement jamais été étudiée, et aucun génome, épigénome, transcriptome, protéome ou description phénotypique de ces parasites n'a été publié à ce jour, en raison des défis techniques associés à la très faible quantité de matériel biologique. La technologie d'aujourd'hui est à un tournant pour aborder ces questions.
-

- Ce réservoir, dont on sait qu'il produit des gamétocytes et les transmet[4], représente le plus grand défi pour l'éradication du paludisme. Cependant, pour éliminer toutes les infections, il faudrait traiter les porteurs qui ne présentent pas de symptômes cliniques et qui ne chercheront probablement pas à se faire soigner. Une campagne qui ne ciblerait que les cas cliniques, les formes les plus virulentes du parasite, risquerait de sélectionner par inadvertance une population présentant un "profil asymptomatique" (c'est-à-dire une faible parasitémie, des infections chroniques), ce qui compliquerait l'effort d'élimination.Les infections asymptomatiques, un défi pour l'élimination du paludisme
- Les infections asymptomatiques : un nouveau modèle pour les interactions entre l'hôte et l'agent pathogène
À l'heure actuelle, les études sur la pathogénie ne recueillent généralement qu'un seul échantillon de sang du patient à son arrivée à l'hôpital, ce qui ne nous donne qu'un instantané de l'interaction entre l'hôte et l'agent pathogène. Je pense que nous pourrions "enregistrer la vidéo" de l'interaction hôte-pathogène grâce à des prélèvements sanguins réguliers sur le même porteur chronique asymptomatique, afin d'étudier l'évolution de la même infection en temps réel (Fig. 3).
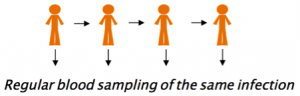
Figure 3
C'est pourquoi, en Gambie, nous avons recruté une cohorte de ~50 volontaires qui étaient porteurs asymptomatiques au début de la saison sèche (décembre 2016). Ces personnes ont été échantillonnées mensuellement pendant une période allant jusqu'à 6 mois. Les résultats épidémiologiques seront décrits dans un post séparé.
Comprendre comment le parasite peut survivre dans un hôte humain pendant des mois nous aidera à développer de nouveaux outils de surveillance génétique et thérapeutiques.
OBJECTIFS :
Pour comprendre comment le parasite est capable de survivre pendant la saison sèche et de déclencher une nouvelle épidémie à la saison humide suivante, nous caractériserons P. falciparum à partir d'infections chroniques, aux niveaux génomique, transcriptomique et phénotypique, ainsi que la réponse immunitaire de l'hôte associée. Plus précisément :
Projet 1 : Identification des allèles de P. falciparum sélectionnés pendant la saison sèche
Le séquençage des génomes de P. falciparum collectés pendant la saison des pluies et la saison sèche permettra d'identifier les allèles du parasite qui sont sélectionnés par le goulot d'étranglement de la population parasitaire dû à l'absence de transmission pendant la saison sèche.
Projet 2 : P. falciparum peut-il détecter son environnement et s'y adapter par le biais de la régulation transcriptionnelle ?
2a: Nous mesurerons le taux de multiplication in vitro du parasite afin de déterminer si les isolats provenant d'infections asymptomatiques se développent plus lentement que les infections virulentes.
2b: En utilisant l'ARN-seq unicellulaire (sc), nous comparerons le transcriptome des parasites collectés en saison sèche et en saison humide. Notre hypothèse est qu'au début de la saison sèche, certaines sous-populations de parasites passent à un état de dormance.
Projet 3 : La variation antigénique peut-elle expliquer les infections chroniques ?
Nous enregistrerons la commutation de l'expression des gènes var et la réponse immunitaire qui lui est associée tous les mois au cours des mêmes infections. Cela révèlera une hypothèse postulée depuis longtemps mais jamais testée formellement, à savoir que la commutation des antigènes de surface est suffisante pour que le parasite échappe au système immunitaire de l'hôte.
Références :
1 Ceesay, S.J. et al. (2008) Changes in malaria indices between 1999 and 2007 in The Gambia : a retrospective analysis. Lancet 372, 1545-54
2 Ceesay, S.J. et al. (2010) Continued decline of malaria in The Gambia with implications for elimination. PLoS One5, 4-13
3 Lindblade, K. a et al. (2013) The silent threat : asymptomatic parasitemia and malaria transmission. Expert Rev. Anti. Infect. Ther. 11, 623-39
4 Stone, W. et al. (2015) Assessing the infectious reservoir of falciparum malaria : Past and future. Trends Parasitol.31, 287-296